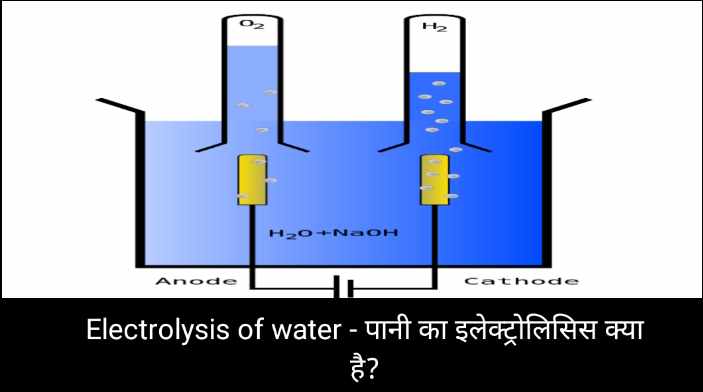
पानी का इलेक्ट्रोलिसिस एक रासायनिक प्रक्रिया है जिसमें विद्युत प्रवाह (आमतौर पर इलेक्ट्रोड द्वारा प्रदान किया जाता है) को पानी (H2O) के माध्यम से पारित किया जाता है, जिससे यह अपने घटक तत्वों, हाइड्रोजन (H2) और ऑक्सीजन (O2) में विघटित हो जाता है। यह प्रक्रिया एनोड और कैथोड पर होती है, जहां कैथोड (नकारात्मक इलेक्ट्रोड) पर हाइड्रोजन गैस उत्पन्न होती है क्योंकि पानी के अणुओं को कम करने के लिए इलेक्ट्रॉनों की आपूर्ति की जाती है, जबकि एनोड (सकारात्मक इलेक्ट्रोड) पर ऑक्सीजन गैस उत्पन्न होती है क्योंकि पानी के अणु ऑक्सीकरण के माध्यम से इलेक्ट्रॉन खो देते हैं। पानी का इलेक्ट्रोलिसिस हाइड्रोजन और ऑक्सीजन गैसों के उत्पादन के लिए एक उपयोगी तरीका है और इसका उपयोग ऊर्जा भंडारण और उत्पादन सहित विभिन्न उद्योगों में किया जाता है। Electrolysis of water – पानी का इलेक्ट्रोलिसिस क्या है?
Electrolysis of water – पानी का इलेक्ट्रोलिसिस क्या है?
पानी का इलेक्ट्रोलिसिस एक रासायनिक प्रक्रिया है जो पानी के अणुओं (H2O) को उनके घटक तत्वों, हाइड्रोजन (H2) और ऑक्सीजन (O2) में विभाजित करने के लिए बिजली का उपयोग करती है। यह प्रक्रिया एक इलेक्ट्रोलाइटिक सेल में होती है, जिसमें आमतौर पर पानी के एक कंटेनर में डूबे हुए दो इलेक्ट्रोड (आमतौर पर प्लैटिनम या ग्रेफाइट जैसी अक्रिय सामग्री से बने) होते हैं।
यहां बताया गया है कि पानी का इलेक्ट्रोलिसिस कैसे काम करता है:
- इलेक्ट्रोलाइटिक सेल: सेटअप में पानी से भरा एक इलेक्ट्रोलाइटिक सेल शामिल है। दो इलेक्ट्रोड, कैथोड (नकारात्मक इलेक्ट्रोड) और एनोड (सकारात्मक इलेक्ट्रोड), पानी में रखे जाते हैं, लेकिन उन्हें एक दूसरे को छूने की अनुमति नहीं होती है।
- विद्युत धारा: जब इलेक्ट्रोडों को किसी शक्ति स्रोत (जैसे बैटरी या बिजली की आपूर्ति) से जोड़कर विद्युत धारा लागू की जाती है, तो पानी रासायनिक प्रतिक्रियाओं से गुजरना शुरू कर देता है।
- कैथोड प्रतिक्रिया: कैथोड पर, जो नकारात्मक रूप से चार्ज होता है, इलेक्ट्रोड के पास पानी के अणु इलेक्ट्रॉन प्राप्त करते हैं और कम हो जाते हैं। इस कमी प्रतिक्रिया के परिणामस्वरूप हाइड्रोजन गैस (H2) बनती है: 2H2O + 2e- → H2(g) + 2OH-
- एनोड प्रतिक्रिया: एनोड पर, जो धनात्मक रूप से चार्ज होता है, पानी के अणु इलेक्ट्रॉन खो देते हैं और ऑक्सीकृत हो जाते हैं। इस ऑक्सीकरण प्रतिक्रिया से ऑक्सीजन गैस (O2) का उत्पादन होता है: 2H2O → O2(g) + 4H+ + 4e-
- समग्र प्रतिक्रिया: पानी के इलेक्ट्रोलिसिस के लिए समग्र प्रतिक्रिया है: 2H2O → 2H2(g) + O2(g) इस प्रक्रिया के दौरान उत्पन्न हाइड्रोजन और ऑक्सीजन गैसों को अलग-अलग एकत्र किया जाता है। इनका उपयोग विभिन्न अनुप्रयोगों के लिए किया जा सकता है:
- हाइड्रोजन: हाइड्रोजन गैस स्वच्छ ऊर्जा वाहक के रूप में काम कर सकती है। इसका उपयोग बिजली उत्पन्न करने के लिए ईंधन कोशिकाओं में, वाहनों के लिए ईंधन के रूप में (हाइड्रोजन ईंधन सेल) और औद्योगिक प्रक्रियाओं में किया जा सकता है।
- ऑक्सीजन: शुद्ध ऑक्सीजन के चिकित्सा और औद्योगिक उपयोग हो सकते हैं, जैसे चिकित्सा ऑक्सीजन टैंक और धातु काटने और वेल्डिंग प्रक्रियाओं में। पानी का इलेक्ट्रोलिसिस न केवल एक मूल्यवान रासायनिक प्रदर्शन है, बल्कि हाइड्रोजन के उत्पादन के लिए भी एक महत्वपूर्ण प्रक्रिया है, जिसे नवीकरणीय ऊर्जा का उपयोग करके उत्पादित करने पर एक स्वच्छ और टिकाऊ ऊर्जा स्रोत के रूप में तेजी से पहचाना जा रहा है। यह प्रक्रिया स्वच्छ ऊर्जा प्रौद्योगिकियों को आगे बढ़ाने और ग्रीनहाउस गैस उत्सर्जन को कम करने में महत्वपूर्ण भूमिका निभाती है।
पानी का इलेक्ट्रोलिसिस एक आकर्षक रासायनिक प्रक्रिया है जो पानी के अणुओं को उनके घटक तत्वों, हाइड्रोजन और ऑक्सीजन में तोड़ने के लिए बिजली का उपयोग करती है। यह प्रक्रिया न केवल अपने वैज्ञानिक महत्व के लिए बल्कि अपने व्यावहारिक अनुप्रयोगों के लिए भी महत्वपूर्ण है, विशेष रूप से ऊर्जा उत्पादन, भंडारण और विभिन्न औद्योगिक प्रक्रियाओं के क्षेत्र में।
पानी का इलेक्ट्रोलिसिस एक इलेक्ट्रोलाइटिक सेल के भीतर होता है, जिसमें पानी के एक कंटेनर में डूबे दो इलेक्ट्रोड होते हैं। ये इलेक्ट्रोड आमतौर पर इलेक्ट्रोड के साथ रासायनिक प्रतिक्रियाओं को रोकने के लिए प्लैटिनम या ग्रेफाइट जैसी अक्रिय सामग्री से बने होते हैं। जब इन इलेक्ट्रोडों के माध्यम से पानी में विद्युत धारा प्रवाहित की जाती है, तो इलेक्ट्रोड सतहों पर रेडॉक्स (कमी-ऑक्सीकरण) प्रतिक्रियाओं की एक श्रृंखला होती है।
कैथोड (नकारात्मक चार्ज इलेक्ट्रोड) पर, पानी के अणु (H2O) इलेक्ट्रॉन प्राप्त करते हैं और हाइड्रोजन गैस (H2) बनाने के लिए कम हो जाते हैं:
2H2O + 2e- → H2(g) + 2OH-
इसके विपरीत, एनोड (धनात्मक आवेशित इलेक्ट्रोड) पर, पानी के अणु इलेक्ट्रॉन खो देते हैं और ऑक्सीजन गैस (O2) उत्पन्न करने के लिए ऑक्सीकृत हो जाते हैं:
2H2O → O2(g) + 4H+ + 4e-
पानी के इलेक्ट्रोलिसिस की समग्र प्रतिक्रिया है:
2H2O → 2H2(g) + O2(g)
हाइड्रोजन और ऑक्सीजन गैसों को क्रमशः कैथोड और एनोड पर अलग-अलग एकत्र किया जाता है। यह प्रक्रिया अत्यधिक शुद्ध हाइड्रोजन और ऑक्सीजन गैसें उत्पन्न करती है, जिनका उपयोग कई अनुप्रयोगों के लिए किया जा सकता है। Electrolysis of water
जल इलेक्ट्रोलिसिस के सबसे आशाजनक अनुप्रयोगों में से एक हरित हाइड्रोजन का उत्पादन है, जिसे स्वच्छ ऊर्जा वाहक माना जाता है। इलेक्ट्रोलिसिस के लिए नवीकरणीय स्रोतों (जैसे सौर या पवन ऊर्जा) से बिजली का उपयोग करके, हम ग्रीनहाउस गैसों का उत्सर्जन किए बिना हाइड्रोजन बना सकते हैं। इस हाइड्रोजन को फिर संग्रहीत किया जा सकता है और ईंधन सेल वाहनों, औद्योगिक प्रक्रियाओं और बिजली उत्पादन सहित विभिन्न उद्देश्यों के लिए उपयोग किया जा सकता है।
संक्षेप में, पानी का इलेक्ट्रोलिसिस एक महत्वपूर्ण रासायनिक प्रक्रिया है जो विद्युत प्रवाह के माध्यम से हाइड्रोजन और ऑक्सीजन गैसों के उत्पादन को सक्षम बनाता है। इस प्रक्रिया का स्वच्छ ऊर्जा उत्पादन, ग्रीनहाउस गैस कटौती और टिकाऊ औद्योगिक प्रथाओं पर महत्वपूर्ण प्रभाव पड़ता है, जिससे यह हरित और अधिक टिकाऊ भविष्य की तलाश में चल रहे अनुसंधान और विकास का क्षेत्र बन जाता है।